오늘 다룰 주제는 화학1 1단원인 '화학의 유용성' 단원에 소개되어있는 하버-보슈법(Haber-Bosch process) 입니다.
질소고정과 하버-보슈법에 각각의 주제를 따로 상세히 다루는 글을 작성할 계획에 있으니 기대해 주세요!
하버 보슈법의 중요성을 이해하기 위해서는 먼저 질소의 중요성에 대해 이야기해야 합니다. 질소(N) 는 단백질과 핵산을 구성하는 필수 원소입니다.
그러나 대부분의 생물은 공기 중의 질소 기체(N2) 를 직접 흡수하여 이용하지 못합니다. 대기의 78%가 질소 기체인데 이를 직접 사용하지 못하는 이유는 무엇일까요? 그 이유는 질소기체 (N2)를 이루는 두 질소 원자 사이의 결합이 삼중결합으로 매우 강하기 때문입니다. 무려 결합에너지가 942kJ/mol 이나 됩니다. 따라서 질소 기체의 결합을 끊기는 매우 어렵습니다.

대부분의 동물은 식물을 섭취하여 단백질과 핵산을 합성하기 위한 질소를 얻거나, 다른 동물을 먹어 질소를 얻습니다. 식물들은 토양으로부터 질소를 얻는데, 이를 위해서는 토양에 식물이 흡수할 수 있는 형태로 질소가 고정되어야 합니다. 토양에 식물이 흡수할 수 있는 상태로 질소가 존재하게 되는 과정을 '질소 고정'이라고 부르고 질소 고정은 다음과 같은 두가지 과정에 의해 일어납니다.
- 번개: 공기 중 질소는 번개의 에너지에 의해 산소와 반응해 물에 녹을 수 있는 물질로 바뀌어 토양에 흡수됩니다.
- 콩과식물의 뿌리에서 공생하는 뿌리혹박테리아에 의해 생물이 사용할 수 있는 형태로 바뀝니다.
이렇게 '질소 고정'이 일어나면, 토양 속에 질산이온(NO3- ) 혹은 암모늄 이온(NH4-) 형태로 질소가 존재하게 됩니다. 식물들은 이렇게 고정된 질소를 뿌리를 통해 흡수합니다.
산업혁명 이후 폭발적인 인구 증가로 인해 식량 부족 문제가 발생합니다. 기존 방식으로 생산되는 천연 비료로는 작물을 충분히 생산하기 어려웠습니다. 이때 등장한 것이 하버-보슈법입니다.
하버-보슈법은 촉매를 이용하여 기존에 인공적으로 생산하지 못했던 암모니아를 대량으로 생산할 수 있게 만든 방법입니다. 하버의 암모니아 생성에 대한 이론을 실현시킬 장치를 보슈가 개발했기 때문에 하버-보슈법으로 불립니다.
하버-보슈법에서, 암모니아 합성 과정의 화학 반응식은 아래와 같습니다.

하버-보슈법에서는 400~600℃의 온도, 200~400atm 의 압력에서 촉매를 사용해 암모니아를 대량 생산할 수 있습니다. 하버-보슈법은 아래 그림과 같은 과정을 통해 암모니아를 생산합니다.
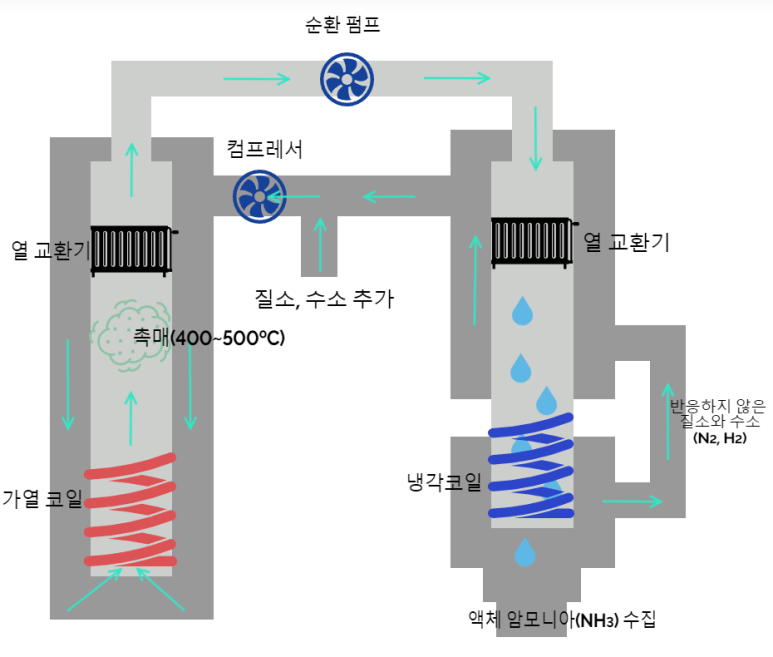
하버-보슈법 덕분에 인류는 질소비료의 원료가 되는 암모니아(NH3)를 대량생산할 수 있게 되었습니다. 이를 통해 산업혁명 이후 폭증한 인구를 먹여살릴 수 있을 만큼의 농산물을 생산할 수 있게 되었습니다. 하버는 이 업적으로 1918년 노벨 화학상을 수상합니다.
화학이 우리 일상에서 얼마나 유용하게 쓰이는지 알아볼 수 있는 예시인 하버-보슈법에 대해 다뤄 보았습니다. 오늘도 제 글을 읽어주셔서 감사합니다. 관심 있으시면 다른 글들도 읽어보시는 것은 어떤가요? 아니면 제 잡다한 글들도 보고싶으시다면, 사이드바의 배너를 클릭해 주세요~ 감사합니다~
reference:
1) 김봉래 외2, 「하이탑 고등학과 화학 I」, 동아출판, 2018,11p
2) https://chemistry4life-natalia-lotte.weebly.com/index.html
'화학 > 고등 화학' 카테고리의 다른 글
| [화학 1] 철의 제련 (0) | 2023.04.26 |
|---|
